
한국뇌연구원에서 위해가능 생물체 및 유전자변형생물체를 이용한 실험을 실시하고자 하는 연구자가 제출한 생물안전 연구계획을 「유전자재조합실험지침」, 「유전자변형생물체의 국가간 이동 등에 관한 법률」 및 「동법 통합고시」에 규정 된 기준에 따라 심의 평가·의결함으로써 연구자의 생물안전을 확보하고자 함
위해가능 생물체 및 유전자변형생물체를 이용한 실험을 실시하고자 하는 연구자는 실험하기 전 LMO를 개발하거나 이를 이용하는 실험에 대해 국가승인, 기관승인, 기관신고를 해야 합니다.
아래 심의별 등급 분류표는 현재까지 위원회에서 심의한 대상을 바탕으로 분류한 자료입니다.
| 분류 | 등급 | 대상 | 해당 LMO |
|---|---|---|---|
| 기관 신고 | BSL-1 | 제1위험군 생물체를 숙주-벡터계 또는 DNA 공여체로 이용하는 실험 |
|
| 유전자변형동물(TG, Knock-out, knock-in mouse) 등을 이용하는 실험 |
|
||
| 기관승인 | BSL-2 | 제2위험군 생물체를 숙주-벡터계 또는 DNA 공여체로 이용하는 경우 |
|
|
|
||
| 대량배양을 포함하는 실험(10리터 이상 병원체 배양) | |||
| 척추동물 1kg 당 치사독소량(LD50)이 0.1~100 ug 이하인 단백성 독소*를 생산할 능력을 가진 유전자를 이용하는
경우 *Abrin, Clostridium perfringens epsilon toxin, Conotoxins, Ricin, Saxitoxin, Shigalike toxin, Shigatoxin, Staphylococcus enterotoxins, Tetrodotoxin |
|||
| 척추동물 1kg 당 치사독소량(LD50)이 100 ug 이하인 단백성 독소*를 이용하는 경우 *Abrin, Clostridium perfringens epsilon toxin, Conotoxins, Ricin, Saxitoxin, Shigalike toxin, Shigatoxin, Staphylococcus enterotoxins, Tetrodotoxin, 보툴리눔독소 (A,B,C,D,E,F형), 파상풍독소, 이질독소, 디프테리아 독소 |
|
||
| 국가승인 | BSL-3 BSL-4 |
|
본원 수행불가 |
| 고위험 병원체를 이용하는 실험(고위험병원체35종 또는 BSL-3) | |||
| 종명까지 명시되지 않고 인체병원성 여부가 밝혀지지 않은 병원체 이용실험 | |||
| 자연적으로 발생하지 않는 방식으로 생물체에 약제내성유전자를 의도적으로 전달하는 경우 |
※ BSL-2 중 사람 감염성은 낮지만 동물 감염성이 높은 경우, 독립된 실험 공간 마련 등 추가 규정에 따른다.
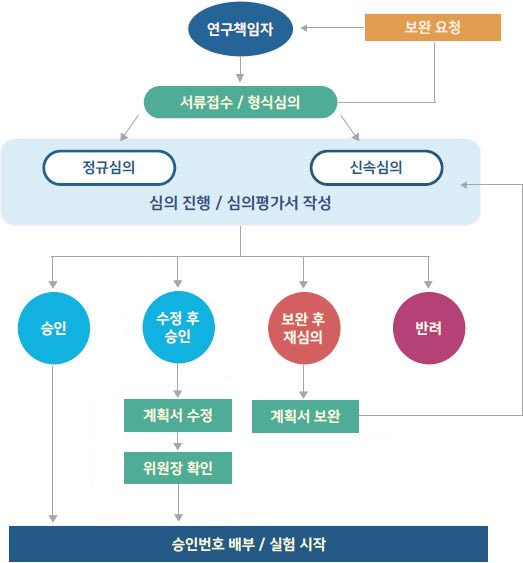
연구과제 책임자인 연구자에 한하여 LMO연구계획서를 심의받을 자격이 있으며, 필요에 따라 과제책임자의 승인 아래 연구과제 참여연구원도 LMO연구계획서를 심의 받을 자격이 있다.
위험군 분류에 대한 기준은 「유전자재조합실험지침」, 「유전자변형생물체의 국가간 이동 등에 관한 법률」 및 「동법 통합고시」을 따르지만, 구체적인 기준은 별도로 위원회에서 정한 바에 따른다.
1) 제1위험군, 제2위험군 바이러스를 자체제작하는 경우
2) Pseudotyped Rabies Virus, Herpes Simplex Virus, Retrovirus 등 사용하는 경우
Lentivirus '위해성 평가서 작성 대상' 제외 사유
3) 상용화 되지 않은 바이러스, 상업용이 아닌 경우, 특히 병원성이나 독성이 의심될 수 있는 경우